Учёные Научно-образовательного центра инфохимии ИТМО предложили алгоритм, который вычисляет, в какой размерности находится молекула: 2D, 3D или в промежуточном состоянии. Метод позволяет быстро определить стадию фолдинга биомолекул и посмотреть на их сворачивание в динамике, что нельзя сделать в существующих подходах. Разработчики описали и сравнили свой алгоритм, основанный на молекулярно-динамических вычислениях, с методом Монте-Карло и популярным алгоритмом машинного обучения AlphaFold в статье в журнале Королевского химического общества.
«Фолдинг белков ― задача тысячелетия для молекулярной биологии, и мы сильно продвинулись в её решении. Работа над этой фундаментальной проблемой сродни составлению генома человека. Очень многие отрасли завязаны на использовании белков, функции которых определяются последовательностью аминокислот и механизмом фолдинга ― свёртывания. От фолдинга зависит, какие процессы будет запускать белок в живых клетках. В фармакологии гидрофобное ядро свёрнутого белка отвечает за связывание с лекарствами. В биомедицине фолдинг может раскрыть механизмы возникновения и прогрессии различных заболеваний и затем ― способы их лечения», ― объясняет первый автор исследования, доктор медицинских наук и лидер группы по хемоинформатике в Центре инфохимии ИТМО Сергей Шитяков.
Между тем, протеиновый фолдинг во многом остаётся загадкой. Аминокислотная последовательность белка может определять его свёрнутую структуру. Но до конца не ясно, как белок находит конечное свёрнутое состояние и почему скорость сворачивания относительно высока ― учитывая огромное число возможных метасостояний, через которые может пройти молекула на пути к свёрнутой форме. В случае белка, который использовали исследователи, процесс занял наносекунды. Столько времени понадобилось небольшому полипептиду Trp-cage, чтобы свернуться из линейной формы в глобулярную. Этот процесс исследователи смогли предсказать с помощью молекулярной динамики молекулы.
«Одно из важнейших открытий биологии ХХ века – что код ДНК устроен как текст или последовательность нуклеотидов. Переход от текста к физическому объекту со своей функцией, то есть к глобулярной молекуле белка, происходит в момент фолдинга. Одномерная цепочка сворачивается уникальным образом в водной среде и превращается в трёхмерную глобулу с определёнными свойствами. Не только с практической, но и с философской точки зрения это очень интересный процесс, и мы хотим математически описать, как именно этот переход происходит, используя понятие дробной размерности, изменяющейся между одномерным и трёхмерным пределами», ― рассказывает один из научных руководителей исследования Михаил Носоновский, лидер группы по трибоинформатике центра инфохимии, профессор Висконсинского университета.
Ключевой в методе стала функция с параметром альфа (α). Она широко используется в физике полимеров, но к белкам ещё не применялась. Альфа выводится из топологии молекулы и её радиуса гирации (вращения), который, по сути, отвечает за компактность свёрнутого белка. Учёные впервые рассчитали эту константу для белков. Когда альфа приближается к 0,333, это значит, что белок в глобулярном состоянии, почти свернулся. Если α = 1, мы видим линейную растянутую молекулу, при α = 0,5 ― идеальную цепочку.
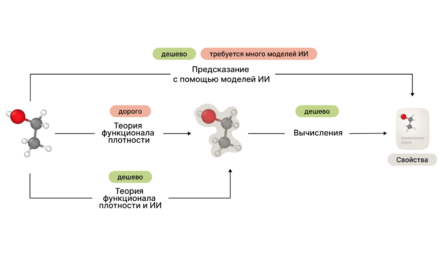
Чтобы использовать метод молекулярной динамики для одного белка, нужно сгенерировать огромное число протеиновых конформаций. Для Trp-cage они были получены и помогли найти значения альфы. Теперь, благодаря альфе, такие анализы можно проводить для любого белка, не проводя in vitro эксперименты. Тот же белок Trp-cage учёные использовали для AlphaFold и других известных алгоритмов для сравнения. Большинство из них не показывает протеиновый фолдинг в динамике, а некоторые требуют использования экспериментальных данных.
Моделирование методом Монте-Карло (Rosetta) ― более быстрый метод. Но для расчёта требуется эталонная структура, обычно получаемая кристаллографически. Методы на основе машинного обучения ― например AlphaFold ― относительно быстры и точны, но выдают конечную модель, не учитывая динамику протеинового фолдинга. Глобулярность белка можно также рассчитать с помощью радиуса гирации, но он всегда разный, а в методе учёных ИТМО ключевой параметр ― константа.
В этой работе исследователи приняли точкой завершения фолдинга близкое к конечному метастабильное состояние, когда у молекулы сформировалось гидрофобное ядро и это резко снизило энергию Гиббса. Далее сворачивание продолжается по гидрофильным участкам молекулы вокруг ядра ― тоже важный процесс, но он занимает на порядки больше времени и сопровождается малым снижением энергии Гиббса.
Исследователи уже работают над более полным фолдингом белков в 3–5 микросекунд, который должен превзойти AlphaFold по эффективности. Как подчеркивает Сергей Шитяков, метод можно применить для разных глобулярных белков. У исследователей уже есть отработанная методология, что позволит создать программу, которая бы рассчитывала альфу для разных белков, в том числе более крупных.
«Можно менять структуру белка или модифицировать раствор: смещать pH, добавлять ионы, лиганды, другие молекулы, например меламин цианурат или циклодекстрин. Они будут влиять на механизм протеинового фолдинга, ― говорит ученый. ― Например, особый класс белков ― шапероны (Hsp90). Они находятся в живых клетках и помогают фолдингу других белков. Есть сведения, что их нормальная функция имеет решающее значение для поддержания здоровья клеток, тогда как нарушение регуляции может способствовать канцерогенезу. Эти функции белков и их изменения можно также исследовать с помощью нашего универсального метода».